Voltar
ASSOCIAÇÃO
SIMBIÓTICA DE Metania spinata (PORIFERA, METANIIDAE)
COM UMA CHLOROPHYCEAE
Maria da Graça G.
Melão1* , Odete Rocha2
1 Departamento
de Hidrobiologia - Universidade Federal de São Carlos -
São Carlos - SP - Brasil.
2Departamento
de Ecologia e Biologia Evolutiva - Universidade Federal
de São Carlos - São Carlos - SP - Brasil
RESUMO
O presente trabalho
visa avaliar a importância de algas simbiontes para uma
população de esponjas de água doce (Metania spinata,
Metaniidae), encontrada na Lagoa Dourada, Brotas, SP, Brasil.
A alga em associação simbiótica com Metania spinata
é Chorycistis sp (Chlorophyceae, Chlorococcales)
e pode localizar-se dentro ou entre as células da esponja,
como evidenciado em estudos com M.E.T. As algas foram quantificadas,
determinando-se também a taxa de produtividade primária
e a importância destas para o crescimento da esponja. A
quantificação da alga mostrou que ela representa, em média,
1,6% do total do volume da esponja. A produtividade primária
das algas, determinada pelo método do oxigênio dissolvido,
foi baixa em termos de produção primária líquida, provavelmente
devido à pequena proporção entre o volume da biomassa algal
e o da esponja, como indicada pela baixa razão P/R, que
foi de 1,4. Em experimentos de luz-escuro, feitos para estimar
a importância relativa da alga para o crescimento de M.
spinata, as taxas de crescimento e as concentrações
de clorofila evidenciaram a importância da alga simbionte,
uma vez que houve uma redução de 50% na taxa média de crescimento
nas gaiolas desprovidas de luz.
Palavras-chave:
Porifera, Metania spinata, simbiose, Chlorophyceae,
produtividade primária, taxas de crescimento.
INTRODUÇÃO
Simbiose com algas verdes
unicelulares é um fenômeno muito difundido entre muitos
dos filos de invertebrados de água doce. Uma variedade de
diferentes aspectos dessa relação alga-invertebrado tem
sido investigada, incluindo nutrição (18), efeito da alga
simbionte na reprodução assexual do hospedeiro (14), respiração
e fotossíntese (9, 10) e outros.
Demonstrações da natureza
dos benefícios dessa associação têm sido feitas de numerosas
formas. Alguns trabalhos (10) documentaram a transferência
de fotossintatos das zooclorelas para as esponjas. Experimentos
de luz-escuro (14) demonstram, em experimentos de luz-escuro,
que há maior sobrevivência, crescimento e competitividade
em organismos com simbiontes ativos, com relação a aposimbiontes.
Alguns autores (7) investigaram o efeito de algas simbiontes
no crescimento de esponjas de água doce, encontrando que
as mesmas têm uma grande importância no desenvolvimento
desses animais.
Alguns trabalhos têm
enfocado o movimento de fotossintatos dos autótrofos para
os heterótrofos em relações simbióticas, havendo uma boa
revisão sobre o assunto (18). Além desse, a alga pode ter
outros efeitos no hospedeiro. Alguns autores sugerem que
as algas simbiontes poderiam beneficiar seu hospedeiro de
várias maneiras, como por exemplo: tomando dióxido de carbono
e produzindo oxigênio durante a fotossíntese, facilitando
assim a respiração e a troca de gases, e tomando excretas
do hospedeiro, como amônia e fosfato, criando um micro-ambiente
menos tóxico para o animal. Ainda há poucas evidências diretas
de que qualquer um desses benefícios seja essencial para
o hospedeiro (14).
Alguns estudos (22,
23) têm demonstrado que essas esponjas, chamadas fototróficas
derivam 50%, ou mais, de sua nutrição das atividades fotossintéticas
das algas simbiontes.
Apesar de todas essas
investigações, a natureza absoluta da relação entre alga
e hospedeiro, em esponjas, permanece desconhecida.
O presente estudo objetiva
avaliar a importância da relação simbiótica entre algas
verdes e uma população de esponjas de água doce (Metania
spinata, Metaniidae), presente na Lagoa Dourada, Brotas,
SP, Brasil (47o 55' 2'' W e 22o 11'
33'' S). Para tal, a alga simbionte foi quantificada, sua
produtividade primária foi determinada e sua importância
para o crescimento da esponja foi avaliada, através de experimentos
de luz-escuro.
MATERIAL E MÉTODOS
Identificação e localização
da alga simbionte
A análise qualitativa
da alga simbionte foi feita pela extração da clorofila da
esponja, utilizando-se o método do metanol a quente (11),
e leitura em espectrofotômetro, varrendo o espectro de 300
a 700 nm. A identificação do material foi feita pelo Prof.
Camilo Dias Jr. (Universidade Federal do Espírito Santo).
Para melhor caracterização
da alga e para a determinação de sua localização nos tecidos
da esponja, foram feitos cortes micrométricos que foram
analisados ao microscópio eletrônico de transmissão (M.E.T.).
O material foi fixado com glutaraldeído 3% e tetróxido de
ósmio 1%, depois incluído em resina, cortado em ultramicrótomo
(Sorvall, Porter-Blumm, ultra-microtome MT-2) com espessura
de 90 a 150µ, observado em M.E.T. (Jeol 100 Cx).
Quantificação da
alga simbionte
Concentração de clorofila
Para a extração da clorofila,
utilizou-se um método combinado de metanol 90% a frio e
a quente, que se mostrou mais eficiente quando comparado
aos métodos tradicionais (11). Nesse método, porções de
esponja, previamente pesadas, foram maceradas com metanol
90%, e deixadas no freezer durante a noite. No dia seguinte,
as amostras foram aquecidas em banho-maria, mantidas por
5 minutos depois que o metanol levantou fervura e por mais
10 minutos com o fogo desligado. Completou-se o volume de
cada uma para 10ml, centrifugou-se por 5 minutos com 3000
a 3500rpm e procedeu-se a leitura em espectrofotômetro Bausch
& Lomb mod. 700, em 665nm (pico de absorção da clorofila
a) e 750nm (turbidez). A concentração de clorofila
foi calculada em microgramas por grama de peso seco sem
cinzas (gPSSC) de esponja.
Densidade de algas
nas esponjas
Quatro amostras de esponjas
foram pesadas, maceradas e lavadas com água destilada até
que ficassem com coloração esbranquiçada. O volume das suspensões
algais obtidas foi completado até 50ml e, após homogeneização,
a contagem das algas foi feita em câmara de Neubauer. A
partir do valor médio de células/ml, foi estimado o número
de células algais por gPSSC e por ml de esponja.
Biovolume das algas
O diâmetro de várias
algas foi medido e seus volumes foram calculados pela fórmula
do volume de uma esfera (4/3.p .r3). A partir
do volume médio de cada alga simbionte e do número de algas
por gPSSC de esponja, determinou-se o volume de algas por
gPSSC e por ml de esponja, e o volume das algas, em termos
percentuais, com relação à esponja.
Importância da alga
simbionte para a esponja
Para se avaliar a importância
das algas simbiontes no crescimento das esponjas, foi montado
um experimento de luz-escuro em campo, semelhante aos realizados
por outro autor (5), com dois objetivos básicos: (a) monitoramento
da presença de simbiontes fotossinteticamente ativos pela
análise da clorofila e (b) comparação das taxas de crescimento
entre a gaiola com luminosidade normal e com luminosidade
reduzida. Para tal, foram utilizadas 2 gaiolas de metal,
onde foram suspensos seis recipientes cilíndricos (5cm de
diâmetro e 10cm de altura) previamente pesados,
confeccionados com tiras
de PVC e tule, onde foram colocadas porções de esponja de
peso fresco também conhecido. Nas mesmas gaiolas, intercalados
com os recipientes de crescimento, foram suspensos saquinhos
de tule (seis em cada gaiola) com porções de esponja, para
análise da variação da concentração de clorofila ao longo
do experimento.
Uma dessas gaiolas foi
mantida em condições de luminosidade normal (Figura 1a)
e a outra foi mantida no escuro com um sistema de sombreamento
em forma de túnel (Figura 1b), onde a água pode circular,
permitindo a oxigenação da esponja e evitando a redução
do fitoplâncton. O experimento teve duração de 89 dias,
de 19/01 a 17/04/1990.
Os cilindros de crescimento,
tanto da gaiola escura quanto da clara, foram retirados
e pesados ao término desse período, calculando-se, então,
a taxa de crescimento relativo ao mês e a taxa de incremento
em termos de porcentagem do peso inicial por dia. Das esponjas
utilizadas para análise da clorofila, uma parte foi retirada
após aproximadamente metade da duração do experimento (42
dias) e o restante foi retirado ao final do período (89
dias).
Produção primária
das algas simbiontes
A produção primária
das algas simbiontes foi determinada pelo método das garrafas
claras e escuras, através da variação da concentração do
oxigênio dissolvido, (21).
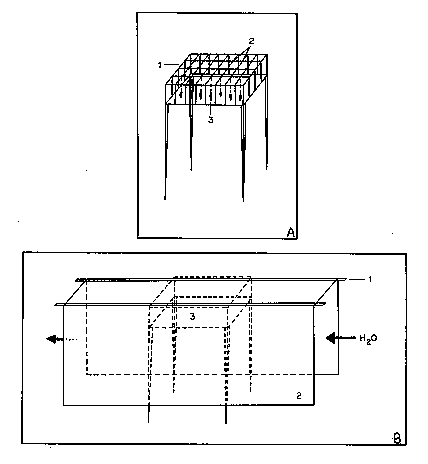
Figura 1 - Modelos das
gaiolas utilizadas nos experimentos de luz-escuro.
(A) Gaiola clara (1);
pontos onde foram suspensas as esponjas (2); esponjas (3).
(B) Gaiola com sombreamento
em forma de túnel (3); ripas de madeira (1); plástico preto
(2).
Neste experimento foram
usados um frasco-controle inicial com água da represa (fixado
no início do experimento), quatro frascos experimentais
(dois claros e dois escuros) com porções equivalentes de
esponjas previamente pesadas, e quatro frascos-controle
finais (dois claros e dois escuros) apenas com água da represa.
Os frascos foram incubados in situ por 3 e 5 horas,
a 30cm de profundidade.
A diferença entre a
concentração de oxigênio da garrafa inicial e das garrafas
escuras com esponjas, forneceu o valor da respiração das
esponjas + plâncton, enquanto que a diferença entre a concentração
de oxigênio do frasco inicial e dos escuros sem esponjas,
forneceu apenas a respiração do plâncton. A diferença entre
os dois valores, corresponde à respiração do sistema alga-esponja.
Da mesma forma, a diferença entre a concentração do oxigênio
das garrafas claras com esponjas e a inicial, equivale à
produção primária líquida (fotossíntese-respiração) do plâncton
e das algas simbiontes da esponja, enquanto a diferença
entre as garrafas claras sem esponjas e a inicial, corresponde
à produção líquida apenas do plâncton. A diferença entre
esses valores é igual à produção primária líquida das algas
simbiontes. A produção primária bruta (PPB) do sistema alga-esponja
corresponde à soma de sua respiração (R) e de sua produção
primária líquida (PPL).
As concentrações de
oxigênio foram determinadas pela técnica de Winkler, com
modificação da azida sódica (11).
A produção primária
líquida foi expressa em mgC gPS-1 h-1
e a respiração foi expressa em mgC gPS-1 h-1
e em mgO2 gPSSC-1 h-1, para fins de
comparação com trabalhos de outros autores. O fator utilizado
para conversão de mgO2 em mgC foi 0,312, (21).
Com base nos valores
de produção primária e respiração do sistema alga-esponja,
determinou-se a razão P/R, com o intuito de se avaliar a
importância das algas simbiontes para a comunidade como
um todo.
RESULTADOS
Identificação e localização
da alga simbionte
O espectro de absorção
das algas simbiontes (Figura 2a e b) apresentou dois picos
no visível: um no azul, próximo a 430nm (clorofilas e carotenóides)
e outro no vermelho, próximo à 663nm (só clorofilas). Os
resultados da análise qualitativa indicaram tratar-se de
uma Chlorophyceae por apresentar 2 picos de absorção, um
a 442nm e outro a 468nm, que correspondem, respectivamente,
a dois pigmentos característicos,
a violaxantina e a neoxantina (4). O gênero foi identificado
como Choricystis (Dias Jr., comunicação pessoal).
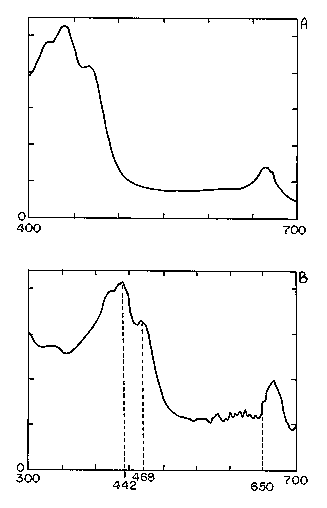
Figura 2 - Espectro
de absorção luminosa da alga simbionte de M. spinata.
(A) Amostra fresca.
(B) Cultura.
Observações ao M.E.T.
mostraram que as algas são encontradas dentro das células
da esponja (Figura 3) sendo, portanto, simbiontes verdadeiros.
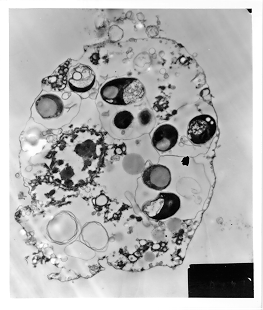
Figura 3 - Fotomicrografia
de transmissão de uma célula de esponja, mostrando a localização
das algas simbiontes (aum. 1.800X).
Quantificação da
alga simbionte
A análise quantitativa
da clorofila a da alga simbionte por unidade de peso
de esponja, resultou numa média de 292,71µg cl.a
gPSSC-1 esponja. A densidade da alga simbionte
no tecido da esponja, foi de 5,2 x 109 células.ml-1
esponja ou 1,4 x 1011 células gPSSC-1
esponja.
A alga simbionte apresentou
um diâmetro médio de 1,83 ± 0,52µ e um volume médio de 4,02µ3.
O volume de algas calculado por unidade de peso de esponja
foi de 0,016cm3 alga ml-1 esponja
ou 0,4494cm3 alga gPSSC-1 esponjas.
As algas simbiontes representam, portanto, 1,6% do volume
da esponja.
Importância da alga
simbionte para M. spinata
Os resultados, em termos
de crescimento, do experimento de luz-escuro estão representados
na Tabela 1. Na gaiola clara houve um aumento considerável
do peso médio (gPS) durante o experimento, com um crescimento
relativo médio de 0,8544 gPS gPS-1 mês-1.
Na gaiola escura houve um aumento de peso menor: o crescimento
relativo médio praticamente se reduziu à metade (0,4482
gPS gPS-1 mês-1). A taxa de crescimento
em termos de porcentagem de incremento diário com relação
ao peso inicial, foi de 2,7% ao dia para a gaiola clara
e 1,3% para a escura.
Tabela 1 - Variação
do peso (gPS) e taxas de crescimento relativo (gPS.gPS-1.mês-1)
das esponjas, nos experimentos de luz-escuro (de 19/01 a
17/04/1990).
A: GAIOLA CLARA
| |
Peso
seco (g) |
Cresc.
relativo |
| No |
19/1 |
17/4 |
de
19/1 a 17/4 |
| 1 |
0,8852 |
2,8051 |
0,7394 |
| 2 |
0,8416 |
3,0940 |
0,9124 |
| 3 |
0,8214 |
2,7405 |
0,7965 |
| 4 |
1,0991 |
2,9899 |
0,5865 |
| 5 |
0,6229 |
2,1223 |
0,8206 |
| 6 |
0,4865 |
2,2999 |
1,2707 |
| Média |
0,7828 |
2,6753 |
0,8544 |
| D.
padrão |
0,2137 |
0,3853 |
0,2307 |
B: GAIOLA ESCURA
| |
Peso
seco (g) |
Cresc.
relativo |
| No |
19/1 |
17/4 |
de
19/1 a 17/4 |
| 1 |
0,7343* |
- |
- |
| 2 |
0,4882 |
1,4122 |
0,6452 |
| 3 |
0,5705* |
- |
- |
| 4 |
0,6923* |
- |
- |
| 5 |
0,9401 |
1,4065 |
0,1691 |
| 6 |
0,5971 |
1,5260 |
0,5303 |
| Média |
0,6751 |
1,4482 |
0,4482 |
| D.
padrão |
0,2358 |
0,0674 |
0,2484 |
* = amostras perdidas
As esponjas da gaiola
escura tomaram uma forma mais delgada, com uma coloração
verde claro, sendo seu estado fisiológico ao final do experimento,
muito mais deteriorado do que as da gaiola clara. Ao término
do experimento, quase todas as esponjas, tanto da gaiola
clara quanto da escura, haviam formado gêmulas.
Os resultados da análise
de clorofila desse experimento estão na Tabela 2. Os dados
mostram que as amostras de esponjas retiradas da gaiola
clara após 42 dias, estavam ainda verdes e vistosas, apresentando
concentrações de clorofila relativamente altas (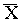 = 345,76µg cl.a gPSSC-1 esponja; S
= 31,06), inclusive maiores do que a concentração inicial
(279,65µg cl.a gPSSC-1 esponja). Já as
retiradas após 89 dias, não apresentavam um estado fisiológico
tão bom, uma parte delas apresentando coloração marrom e
gêmulas; a média de clorofila a foi 131,52µg gPSSC-1
esponja (S = 161,57).
= 345,76µg cl.a gPSSC-1 esponja; S
= 31,06), inclusive maiores do que a concentração inicial
(279,65µg cl.a gPSSC-1 esponja). Já as
retiradas após 89 dias, não apresentavam um estado fisiológico
tão bom, uma parte delas apresentando coloração marrom e
gêmulas; a média de clorofila a foi 131,52µg gPSSC-1
esponja (S = 161,57).
Na gaiola escura, tanto
as amostras coletadas após 42 dias, como no final, após
89 dias, já apresentavam coloração marrom e algumas haviam
formado gêmulas, observando-se uma drástica redução na concentração
de clorofila a. As médias da concentração de clorofila
foram 4,14 e 18,20µg gPSSC-1 esponja, respectivamente
(S = 5,84 e 16,25).
Produção primária
das algas simbiontes
A Tabela 3 mostra os
resultados dos experimentos de produção primária, em que
a PPL apresentou um valor médio de 0,442 mgC gPS-1
h-1 (ou 2,7660mgO2 gPSSC-1
h-1); a média da respiração foi 1,1038 mgC gPS-1
h-1 (ou 6,8707 mgO2 gPSSC-1
h-1) e a média da PPB foi de 1,5480 mgC gPS-1
h-1 (ou 9,6370 mgO2 gPSSC-1
h-1). A razão P/R foi igual a 1,4.
DISCUSSÃO E CONCLUSÕES
Identificação e localização
da alga simbionte
Embora associações com
Chlorophyceae sejam comuns em ambientes de água doce, não
há nenhuma referência bibliográfica do gênero Choricystis
vivendo em associação simbiótica com esponjas.
A localização da alga
dentro do hospedeiro pode variar em diferentes associações:
em esponjas de água doce e suas gêmulas, elas ocorrem primariamente
dentro dos arqueócitos (20). Em esponjas marinhas, estudos
demonstraram que as algas simbiontes podem se localizar
tanto no mesohilo, como dentro das células da esponja (17).
Tabela 2 - Variação
da concentração de clorofila em experimentos de luz-escuro
(de 19/01 a 17/04/1990).
A: GAIOLA CLARA
| Data |
No |
GPSSC |
Leitura |
Clorofila
a |
Observações |
|
|
Esponja |
665
nm |
750
nm |
µg/gPSSC
esp. |
(coloração) |
| 19/1 |
inicial |
0,226 |
0,46 |
0,005 |
279,65 |
Verde |
| 1/3 |
1 |
0,0189 |
0,50 |
0 |
367,72 |
Verde |
| 1/3 |
2 |
0,0206 |
0,48 |
0 |
323,79 |
Verde |
| 17/4 |
3 |
0,0226 |
0,60 |
0 |
369,03 |
Verde |
| 17/4 |
4 |
0,0188 |
0,09 |
0 |
66,49 |
verde
claro, gêmulas |
| 17/4 |
5 |
0,0185 |
0,11 |
0 |
82,70 |
Marrom |
| 17/4 |
6 |
0,0178 |
0,01 |
0 |
7,87 |
marrom,
gêmulas |
B: GAIOLA ESCURA
| Data |
No |
GPSSC |
Leitura |
Clorofila
a |
Observações |
|
|
Esponja |
665
nm |
750
nm |
µg/gPSSC
esp. |
(coloração) |
| 1/3 |
1 |
0,0169 |
0,01 |
0 |
8,28 |
marrom,
gêmulas |
| 1/3 |
2 |
0,0162 |
0 |
0 |
0 |
marrom |
| 17/4 |
3 |
0,0168 |
0 |
0 |
0 |
marrom |
| 17/4 |
4 |
0,0177 |
0,05 |
0 |
39,55 |
marrom,
gêmulas |
| 17/4 |
5 |
0,0164 |
0,02 |
0 |
17,07 |
marrom |
| 17/4 |
6 |
0,0173 |
0,02 |
0 |
16,19 |
marrom |
As algas simbiontes
de M. spinata ocorrem dentro das células da esponja
e, aparentemente, também no mesohilo.
Quantificação da
alga simbionte
Alguns autores (10),
observaram que a maioria das células de Spongilla lacustris,
particularmente os arqueócitos, contém um grande número
de inclusões de zooclorelas simbióticas, tanto em esponjas
ativas quanto em gêmulas. Para quantificar essas algas,
os autores fizeram determinações de clorofila a por
unidade de peso de esponja e encontraram valores de 60µg
cl.a gPF-1 para S. lacustris e
de 460µg cl.a gPF-1 para uma esponja de
água doce não identificada.
Neste trabalho, para
M. spinata, obteve-se um valor médio de 292,71µg
cl.a gPSSC-1, ou, quando convertido para
a mesma unidade utilizada pelos autores supracitados, 51,21µg
cl.a gPF-1, um valor bem próximo ao encontrado
para S. lacustris.
Tabela 3 - Experimentos
de produção primária do sistema alga-esponja. (A) Concentrações
de oxigênio (mg.l-1), peso seco das esponjas
e duração dos experimentos. (B) Produção primária líquida
(PPL), respiração (R) e Produção primária bruta (PPB).
A)
| Experimento |
A |
B |
C |
D |
| Duração
(h) |
5 |
5 |
3 |
3 |
| Inicial |
10,09 |
8,08 |
9,99 |
8,17 |
| Claro
c/ esponja |
9,43 |
8,48 |
9,66 |
7,49 |
| Claro
s/ esponja |
9,22 |
7,71 |
9,42 |
6,80 |
| Escuro
c/ esponja |
7,10 |
4,91 |
8,33 |
5,80 |
| Escuro
s/ esponja |
9,51 |
7,65 |
9,55 |
6,62 |
| PS
esponja (claro) |
0,0736 |
0,0796 |
0,0751 |
0,1065 |
| PS
esponja (escuro) |
0,0646 |
0,0879 |
0,0878 |
0,0842 |
B)
I) mgC.gPS-1.h-1
| Experimento |
PPL |
R |
PPB |
| A |
0,1780 |
0,0145 |
0,1925 |
| B |
0,5997 |
1,9487 |
2,5484 |
| C |
0,3254 |
1,4392 |
1,7646 |
| D |
0,6738 |
1,0128 |
1,6866 |
| Média |
0,4442 |
1,1038 |
1,5480 |
| D.
padrão |
0,2323 |
0,8208 |
0,9839 |
II) mgO2.gPSSC-1.h-1
| Experimento |
PPL |
R |
PPB |
| A |
1,1170 |
0,0917 |
1,2087 |
| B |
3,7500 |
12,1192 |
15,8692 |
| C |
2,0412 |
8,9602 |
11,0014 |
| D |
4,1560 |
6,3125 |
10,8645 |
| Média |
2,7660 |
6,8709 |
9,6370 |
| D.
padrão |
1,4312 |
5,1049 |
6,1218 |
A proporção de organismos
simbiontes, a concentração de clorofila em função de diferentes
espécies algais, ou ainda diferenças fisiológicas nas células
algais, no entanto, variam consideravelmente de uma espécie
para a outra, como pode ser evidenciado pelo conteúdo de
clorofila a encontrado em dez espécies marinhas (22),
que variou de 1,9 a 116,1µg cl.a gPF-1.
Burkholder & Burkholder
(1959 e 1960, apud 10) encontraram para corais, valores
de 115 a 528µg cl.a gPF-1 e para vários
Anthozoa, valores que variaram entre 30 e 336µg cl.a
gPF-1.
Os resultados da contagem
das algas simbiontes de M. spinata, indicaram uma
altíssima densidade por unidade de volume de esponja (5,2
109 células ml-1 esponja), sugerindo
grande importância das algas para esse porífero.
No que diz respeito
ao biovolume das algas simbiontes em relação à esponja,
o valor encontrado foi ligeiramente mais baixo do que os
registrados na literatura: 0,016cm3 alga ml-1
esponja, o que resultou numa proporção de 625:1 (hospedeiro:alga).
Muscatine (1961, apud 19), registrou uma razão de
332:1 (hospedeiro:alga) para anêmonas do Oceano Pacífico,
enquanto outro autor (19) registrou uma razão média de 293:1
para Anemonia sulcata, mas com valores variando de
178:1 a 410:1.
Importância da alga
simbionte para M. spinata
Os resultados das análises
de clorofila a indicaram que o potencial de contribuição
da alga para o crescimento de M. spinata, em condições
de luminosidade reduzida, foi pequeno. Tanto nas análises
das amostras retiradas em 01/03, quanto nas retiradas em
17/04 da gaiola escura, houve uma drástica redução de clorofila
a. A diminuição da concentração de clorofila nas
amostras da gaiola clara de 17/04 com relação à 01/03, deve
ter sido devido à redução da esponja e formação de gêmulas
características nessa época do ano. Mesmo esponjas de coloração
marrom apresentaram ainda alguma quantidade de clorofila,
que resulta de algumas poucas células que ainda continham
simbiontes ativos, ou das próprias gêmulas, que podem conter
algas simbiontes. No presente trabalho a ausência da atividade
algal nas esponjas da gaiola escura, teve um efeito dramático
sobre o crescimento de M. spinata.
Alguns estudos mostram
que a simbiose de algas com invertebrados tem influência
no crescimento e manutenção de uma variedade de organismos
(13, 15). No entanto, esses estudos foram conduzidos em
laboratório ou em sistemas semi-naturais. Na primeira investigação
sobre o papel das algas simbiontes em condições naturais
(7), foi observada uma grande redução na concentração de
clorofila a em experimentos com luminosidade reduzida
e um crescimento maior naqueles sob luminosidade normal.
O crescimento das esponjas submetidas à falta de luz foi
de apenas 20% do crescimento das esponjas sob condições
normais, em 1975. O aumento médio encontrado pelos autores
nesse experimento foi de 4,1 e 0,8mgPSSC dia-1
para esponjas de gaiolas claras e escuras, respectivamente.
Em experimentos semelhantes desenvolvidos pelos mesmos autores
em 1976, as esponjas das gaiolas escuras exibiram uma taxa
de crescimento de 49% da taxa das esponjas sob luminosidade
normal. O aumento médio por dia, durante esse período, foi
de 4,6 e 2,2mgPSSC para as esponjas das gaiolas claras e
escuras, respectivamente.
No presente trabalho,
se os dados de crescimento de M. spinata forem convertidos
para a unidade utilizada pelos autores citados (7), resultam
num aumento médio de 11,6mgPSSC dia-1 para as
esponjas da gaiola clara, e de 4,7mgPSSC dia-1
para as esponjas da gaiola escura, valores algo maiores
do que os encontrados por esses autores, provavelmente devido
às diferenças de temperatura do ambiente, uma vez que seus
experimentos foram realizados em região temperada.
Os dados obtidos neste
trabalho, demonstram que as algas têm grande influência
no crescimento de M. spinata, uma vez que houve uma
redução de cerca de 50% na taxa média de crescimento nas
gaiolas escuras, confirmando a idéia de que as mesmas são
componentes importantes da associação.
Essa importância tem
sido também observada por outro autor (23), que analisando
esponjas fototróficas marinhas, constatou que estas derivavam
50%, ou mais, de sua nutrição da fotossíntese das algas
simbiontes. Segundo Sàra & Vacelet (apud 12),
o volume que os simbiontes ocupam nos tecidos de certas
demospongias e suas taxas de síntese superiores à do animal,
sugerem uma importância fisiológica e ecológica considerável.
Produção primária
das algas simbiontes
As poucas medidas de
respiração feitas para esponjas variam bastante, com valores,
por exemplo, entre de 0,25 a 0,75mlO2 gPSSC-1 h-1
para uma espécie marinha temperada (3). No presente trabalho
os valores de respiração de M. spinata variaram entre
1,3 e 6,69mlO2 gPSSC-1 h-1,
provavelmente mais elevados devido à temperatura mais alta
do corpo de água em que M. spinata ocorre.
Para S. facustris,
num mês de verão, autores (10) encontraram um valor médio
de 9,1mgO2 gPSSC-1 h-1;
em M. spinata os valores, na mesma unidade, variaram
entre 1,6 e 9,6.
Para três espécies marinhas
(16) foram registrados valores de 4,0 e 16,2µgO2
gPS-1 minuto-1. O mesmo autor, em
1981, apresentou um valor de 17,9µgO2 gPS-1
minuto-1, para outra espécie marinha. Os valores
de M. spinata, convertidos para essa unidade, foram
mais altos, variando entre 14,5 e 85,4µgO2 gPS-1
minuto-1.
Algas e bactérias simbiontes
têm uma grande influência no consumo de oxigênio das esponjas
(6). S. lacustris, com abundantes algas simbiontes,
exibe taxas respiratórias ao menos cinco vezes maior (8)
do que as esponjas marinhas estudadas por outro autor (16).
Isso mostra a importância dos simbiontes na energética da
esponja.
A respiração das esponjas
também é influenciada pela temperatura, com valores maiores
em temperaturas maiores (2), pelo tamanho das esponjas (maior
em esponjas menores) e pelo transporte de água, responsável
por grande parte da demanda respiratória da esponja (6).
Os valores de respiração
de M. spinata foram relativamente altos quando comparados
aos de outros invertebrados bentônicos (1).
Os valores de PPL parecem
ter sido subestimados, quando comparados com valores obtidos
por outros autores. Autores (10), usando a técnica do oxigênio
para a determinação da produção primária de S. lacustris,
obtiveram um valor médio de PPL (22mgO2 gPSSC-1
h-1) aproximadamente oito vezes maior do que
o obtido neste trabalho e, consequentemente, um valor médio
de PPB também maior (31,1mgO2 gPSSC-1
h-1). Assim, a relação P/R obtida por esses autores
foi de 3,4, enquanto que a obtida neste trabalho foi de
1,4, para um período de incubação de 5 horas (das 10:00
às 15:00 horas).
Uma possível causa para
a diferença entre esses valores de PPL pode decorrer do
fato de os autores citados terem considerado a produção
de oxigênio e respiração do plâncton negligenciáveis nos
experimentos com esponja e plâncton juntos, não tendo sido
feitas as correções para o metabolismo do plâncton, resultando
numa superestimação destes valores. Essas correções foram
feitas para os cálculos de produção e respiração de M.
spinata. O valor da relação P/R igual a 1,4 indica que
houve um balanço positivo de produção primária do sistema
alga-esponja, contribuindo, portanto, para a produção da
represa como um todo.
A importância da associação
para as esponjas tem sido investigada por vários autores.
A importância das cianobactérias
para esponjas marinhas foi examinada (22), com a determinação
de seu potencial fotossintético (P/R), obtendo-se valores
que variaram de 0,28 a 4,31, indicando que a fotossíntese
dos simbitontes pode, potencialmente, fornecer boa parte
da energia necessária para a sobrevivência das esponjas,
se a transferência de energia se dá pela passagem do fotossintato
da alga simbionte para o hospedeiro, como demonstraram outros
autores (24). Potenciais fotossintéticos (P/R) de 0,3 a
6,3 foram encontrados para esponjas marinhas e de 1,6 a
6,3, para corais (22).
As trocas metabólicas
entre alga e esponja, sugeridas por alguns autores (20)
e demonstradas por outros (15). Esses autores mostraram
que algas simbióticas de um ciliado, uma esponja e uma hidra,
excretam 86,7% de seu fotossintato total como maltose ou
glicose, enquanto que as de vida livre liberam uma quantidade
bem menor (7,6%) e a maioria sob a forma de ácido glicólico.
Segundo esses autores, o controle e a utilização do glicerol
excretado por algas simbiontes, representa um mecanismo
pelo qual as zooxantelas contribuem para a produtividade
dos recifes de coral. Outros pesquisadores (10) também mostraram
que há transferência de fotossintatos das zooclorelas simbiontes
para as células de esponja.
A intensidade com que
a alga contribui para a nutrição da esponja depende do regime
de luz e da profundidade do habitat. Até agora nenhuma quantificação
desse processo foi feita.
AGRADECIMENTOS
Agradecemos ao Instituto
de Biociências da UNESP de Rio Claro, em especial à Carminda
Landin, pela utilização do ultramicrótomo e do microscópio
eletrônico de transmissão.
ABSTRACT
Symbiotic association
of Metania spinata (Porifera, Metaniidae) and Chlorophyceae.
The present work aimed to estimate the importance of a simbiont
algae to a freshwater sponge population (Metania spinata,
Metaniidae) at "Lagoa Dourada" in the "Lobo" Watershed,
Brotas District, São Paulo State, Brazil. The simbiont algae
was identified as Choricystis (Chlorophyceae, Chlorococcales).
The density of the algae in the sponge tissue and its productivity
were determined. The importance of the algae to the sponge's
growth was estimated by field light-dark experiments (cages).
Algae's quantifications have shown that it represents, as
a mean, 1,6% of the total volume of sponge. The primary
productivity was estimated by dissolved oxygen method (light
and dark bottles). The sistem algae-sponge had low values
of net primary production, due to the small proportion of
algae biomass to that of sponges, as shown by the low ratio
P/R, which was only 1,4. In the light-dark experiments,
performed to estimate the relative importance of the algae
to M. spinata, growth rates and chlrophyll concentrations
were determined and have shown an important role of the
simbiont algae, since a reduction of 50% in the mean growth
rates at the cages without light was observed.
Key words: Porifera,
Metania spinata, symbiosis, Chlorophyceae, primary
productivity.
REFERÊNCIAS BIBLIOGRÁFICAS
- Asmus, H.; Theede, H.; Neuhoff, H.G.;
Schramm, W. The role of epibenthic macrofauna in the oxygen
budget of Zostera communities from Baltic Sea.
Ophelia (Supl. 1): 99-111, 1980.
- Barthel, D. On the ecophysiology
of the sponge Halichondria panicea in Kiel Bight.
II. Biomass, production, energy budget and integration
in environmental processes. Mar. Ecol. Prog. Ser.,
43: 87-93, 1988.
- Barthel, D. & Theede, H. A new
method for the culture of marine sponges and its application
for experimental studies. Ophelia, 25(2):
75-82, 1986.
- Bourrelly, P. Les alges d'eau
douce. I: Les alges vertes. Paris, N. Boubeé, 1972.
572p.
- Frost, T.M. Clearance rate determinations
for the freshwater sponge Spongilla lacustris:
effect of temperature, particle type and concentration,
and sponge size. Arch. Hydrobiol., 90: 330-356,
1980.
- Frost, T.M. Porifera. In: Animal
energetics. New York, Academic Press, 1987. v.11,
p.27-53.
- Frost, T.M. & Williamson, C.E.
In situ determination of the effect of symbiotic algae
on the growth of the freshwater sponge Spongilla lacustris.
Ecology, 61(6): 1361-1370, 1980.
- Frost, T.M.; Nagy, G.S.; Gilbert,
J.J. Population dynamics and standing biomass of the freshwater
sponge Spongilla lacustris. Ecology, 63(5):
1203-1210, 1982.
- Gilbert, J.J. & Allen, H.L. Studies
on the physiology of the green freshwater sponge Spongilla
lacustris: primary productivity, organic matter, and
chlorophyll content. Verh. Int. Verein. Limnol.,
18: 1413-1420, 1973a.
- ________. Chlorophyll and primary
productivity of some green, freshwater sponges. Int.
Rev. Ges. Hydrobiol., 58: 633-658, 1973b.
- Golterman, H.L.; Clymo, R.S. &
Ohnstad, M.A.M. Methods for physical and chemical analysis
of fresh waters. Oxford, Blackwell, 1978. 213p. (IBP
Handbook, 8).
- Grassé, P.P. (Ed.) Traité de zoologie.
Tome III. Spongiaires. Fasc. I. Anatomie, physiologie,
systematique, ecologie. Paris, Masson, 1973. 716p.
- Karakashian, S.J. Growth of Paramecium
bursaria as influenced by the presence of algal symbionts.
Physiol. Zool., 36: 52-68, 1963.
- Muscatine, L. & Lenhoff, H.M.
Symbiosis of hydra and alga. 1. Effects of some environmental
cations on growth of symbiotic and aposymbiotic hydra.
Biol. Bull., 128: 415-424, 1965.
- Muscatine, L.; Karakashian, S.J.;
Karakashian, M.W. Soluble extracelular products of algae
symbiotic with a ciliate, a sponge and a mutant hydra.
Comp. Biochem. Physiol., 20: 1-12, 1967.
- Reiswig, H.M. Water transport, respiration
and energetics of three tropical marine sponges. J.
Exp. Mar. Biol. Ecol., 14: 231-249, 1974.
- Sarà, M. Ultrastructural aspects
of the symbiosis between two species of the genus Aphanocapsa
(Cyanophyceae) and Ircinia variabilis (Demospongiae).
Mar. Biol., Berlin, 11: 214-221, 1971.
- Smith, D.; Muscatine, L.; Lewis,
D. Carbohydrate movement from autotrophs to heterotrophs
in parasitic and mutualistic symbiosis. Biol. Rev.,
44: 17-90, 1969.
- Taylor, D.L. On the regulation and
maintenence of algal numbers in zooxanthellae-coelenterate
symbiosis, with a note on the nutritional relationship
in Anemonia sulcata. J. Mar. Biol. Assoc. U.K.,
49: 1057-1065, 1969.
- Van Weel, P.B. On the physiology
of the tropical fresh-water sponge, Spongilla proliphereus
Annand. I. Ingestion, digestion and excretion. Physiol.
Comp. Oecol., 1: 110-126, 1949.
- Vollenweider, R.A. A manual on
methods for measuring primary production in aquatic environments.
London, Blackweel, 1974. 223p. (IBP Handbook, 12).
- Wilkinson, C.R. Net primary productivity
in coral reef sponges. Science, 219: 410-412,
1983.
- ________. Foliose dictyoceratida
of the Australian Great Barrier Reef. II - Ecology and
distribution of these prevalent sponges. Mar. Ecol.,
9(4): 321-327, 1988.
- Wilkinson, C.R. & Vacelet, J.
Transplantation of marine sponges to different conditions
of light and current. J. Exp. Mar. Biol. Ecol.,
37: 91-104, 1979.

